 Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
L'oxygène singulet et la vie: partie B- L'oxygène singulet in vivo
C Deby
 Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
Université de Liège - Centre de l'Oxygène, Recherche et Développement (CORD)
L'oxygène singulet et la vie: partie B- L'oxygène singulet in vivo
C Deby
Depuis les hypothèses d'Allen et al71, l'apparition de l'oxygène singulet dans les milieux biologiques fait toujours l'objet de controverses, souvent acharnées, même au début du 3ième millénaire. Pour étudier une molécule aussi fugace, il faut des moyens techniques directs qui ne sont que rarement applicables in vivo. Nous ne citerons ici que les procédés qui sont utilisables pour essayer de démontrer la réalité d'une formation de 1Δg au sein des cellules.
B.1. Méthodes d'étude
La mise en évidence de l'oxygène singulet in vivo est extrêmement délicate et nécessite le recours à différentes techniques de luminescence, à des piègeurs plus ou moins spécifiques, à l'eau deutérée, etc... L'accumulation de présomptions produite par l'usage de ces divers moyens pourra plaider en faveur d'une intervention de 1Δg.
B.1.1. Chimioluminescence
B.1.1.a. Discussion générale de la signification analytique de la CL
Généré en système biologique complexe, l'oxygène singulet peut réagir avec certains composés dont les produit de réaction peuvent être activés et émettre une luminescence propre présentant diverses longueurs d'onde72. Ainsi peuvent s'expliquer les résultats de Nakano et al.73 montrant au cours d'une expérience les deux raies considérées comme caractéristiques (fig. 17) de 1Δg, mais aussi 3 autres raies de plus courte longueur d'onde (consulter B.2.1.3 ). Dans le phagosome, cette vacuole cytoplasmique créée par la phagocytose, une série de réactions simultanée se produisent, émettant une luminescence rouge (voir B.2.2.3).
Une chimioluminescence observée in vivo n'est pas nécessairement due à l'oxygène singulet, même si elle est rouge : par exemple, la tyrosine excitée émet dans le rouge (B.2.2.3) et les radicaux carbonyles sont eux aussi émetteurs74.
B.1.1.b. Emission à 1260 nm (fig. 16)
La raie à 1260 nm est très spécifique, mais très faible (A.4.2.a.) et donne surtout une indication qualitative. In vivo, les mesures deviennent particulièrement difficiles, car la durée d'existence de 1Δg tombe de 3 msec, en milieu aqueux non vivant, à 0,1-0,2 msec in vivo75,76, car, in vivo, 1Δg réagit plus rapidement avec les molécules du milieu que le temps qu'il lui faut pour se désexciter: dans un milieu cellulaire saturé en O2 (condition optimale), la vitesse de formation de 1Δg a été estimée être de 5 à 10 fois plus lente que celle de sa décroissance77,78; en présence de biomolécules, le temps de survie de 1Δg décroît spectaculairement de ± 3 microsecondes à environ 100 nanosecondes79. La détection et la mesure de 1Δg en milieux biologiques nécessitent un appareillage de détection perfectionné. Krasnovsky80 a passé en revue les divers appareillages conçus pour réaliser ces performances.
En 1981, Khan construisit le premier appareillage de détection ultrasensible comprenant une diode au germanium refoidie à l'azote liquide81. La détection spécifique ultrasensible de l'oxygène singulet se fait au moyen d'une photodiode au germanium (souvent le modèle EO-817P de North Coast, Japan) refroidie par effet Peltier ou à l'azote liquide. Spectrogon vend un filtre interférentiel centré sur 1270 nm. Andover Corp. fournit un filtre "cut-off" ne laissant passer que les longueurs d'onde supérieures à 995 mm. En 2000, Sharman et al. écrivaient, en se basant sur la très courte durée d'existence de 1Δg : " ...direct evidence (of 1Δg) has been illusive"78. Mais très récemment, Niedre et al (2002) ont proposé une méthode de détection de 1Δg "time-resolved"79.
Enfin, signalons les progrès réalisés dans le domaine des PEBBLE (Probes Encapsulated By Biologically Localized Embedding ) qui sont des "nanosenseurs" munis, dans le cas des mesures in vivo de 1Δg , de nano-optodes82.
B.1.1.c. Emissions dans le rouge (fig. 17)
Les 2 raies visibles de 634 et 703 nm sont de moins en moins considérées comme preuve d'apparition de 1Δg, par exemple au cours de la phagocytose (B.2.2.3).
B.1.1.d. La tetra-tert-butylphthalocyanine
Elle capte l'énergie de la décroissance monomoléculaire de 1Δg; elle pourrait être un élément de plus pour décider de la formation d'oxygène singulet dans un système36.
B.1.2. Effet amplificateur de D2O
Nous avons vu plus haut (A.5.1) le mécanisme de ralentissement de la décroissance de 1Δg par l'eau deutérée, ce qui amplifie l'intensité de la luminescence ou d'une réaction d'oxydation.
L'utilisation d'eau deutérée pour confirmer qu'un phénomène dépend de l'oxygène singulet (une chimioluminescence, par exemple) est devenue courante depuis les travaux de Merkel83. D2O fait durer l'existence de 1Δg et amplifie les phénomènes de luminescence, notamment monomoléculaire. Hawco et al.84 ont montré que D2O accélère la décomposition des lipoperoxydes de l'acide linoléique, avec augmentation de l'ultraweak chimioluminescence (uwCL).
B.1.3. Quencheurs et piègeurs spécifiques
L'oxygène singulet réagit avec des molécules susceptibles d'excitation: ce sont les piègeurs (quenchers) d'1Δg. Leur présence dans un milieu interdit toute réaction de 1Δg avec d'autres substances qu'elles-mêmes. Les premiers travaux tentant de mettre en évidence la présence d'1Δg se sont basés sur l'attaque de quenchers réputés spécifiques et oxydés selon une réaction attribuée à l'oxygène singulet.
En 1964, Corey et Taylor85 ont découvert que le diphénylanthracène (DPA) (fig. 32) réagit spécifiquement et rapidement avec 1Δg pour former un endoperoxyde stable dont le spectre présente un pic d'absorption à 355 nm86.
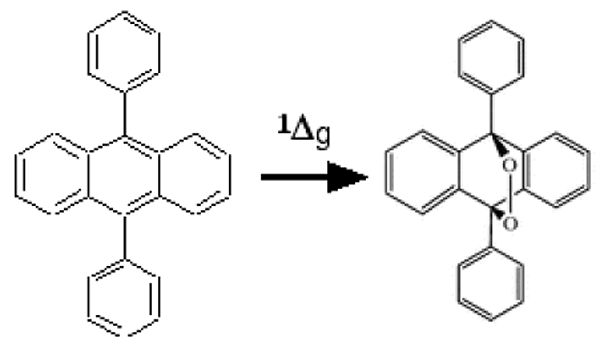
Fig. 32 : 9,10-diphénylanthracène ou DPA (référ. 87).
La liste des piègeurs d'oxygène singulet est longue: nous étudions ici les principaux qui ont été utilisés en biochimie.
B.1.3.a. Le cis-β-carotène8. Sous l'apport énergétique de 1Δg, il passe à la forme trans, au cours d'une réaction EET exothermique (Fig. 33) [Voir A.5.1.c. Quenching par transfert de l'énergie électronique].
15-15'-β-cis-carotène + 1Δg ===> all-trans-β-carotène + 3O2 + chaleur (XIII)
Le carotène est un puissant "quencheur" d'oxygène singulet.
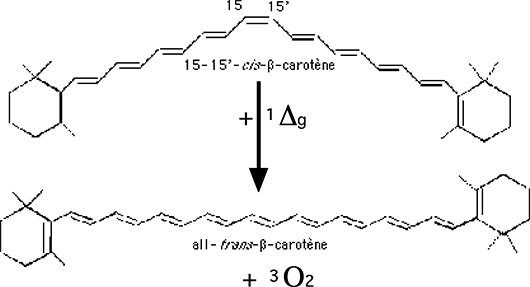
Fig. 33 : L'énergie libérée par 1Δg (22kCal) est utilisée par la molécule de β-cis-carotène pour acquérir la forme β-trans-carotène88
.
Le β-carotène, à la molarité de 10-4M, inhibe 95% des réactions de 1Δg avec une molécule organique89. Une molécule de β-carotène suffit pour pièger au moins 100 molécules de 1Δg89. Ces faits sont à rapprocher des observations de Krinsky90 : les polynucléaires humains tuent beaucoup plus facilement les sarcines non porteuses d'un pigment caroténoïde que les souches mutantes en contenant.
D'autres caroténoïdes possèdent ces propriétés91.
B.1.3.b. Le diphényl-iso-benzofuranne ou DPBF92. Ce composé réagit lentement avec l'oxygène triplet, d'ou la nécessité de préparer ses solutions extemporanément. Celles-ci présentent une fluorescence vert-bleuâtre; l'absorption caractéristique se situe vers 410 nm. La perte de fluorescence permet de doser l'apparition d'espèces oxydantes, telles que les radicaux ROO•, formées dans un milieu et non exclusivement le 1Δg93. L'utilisation dans un milieu aqueux nécessite le recours au polyéthylène glycol 400. Il peut se dimériser en perdant sa fluorescence caractéristique (cause d'artefact dans la mesure des oxydants). Le DPBF ne peut être considéré comme un "quencheur" physique puisqu'il disparaît en cours de réaction (fig. 34). Sa cinétique de réaction avec 1Δg a été particulièrement étudiée par Matheson94 et Merkel95 (fig. 34 et 35). Il a été souvent employé dans des réactions de peroxydation, pour déterminer l'importance de son rôle dans ces phénomènes96-105.
Néanmoins, dès 1975, on s'aperçut que tout initiateur de radicaux libres, dans un milieu donné, peut amorcer une autoxydation du DPBF dissous106. Les résultats obtenus avec ce réactif doivent donc être interprétés avec la plus grande prudence.
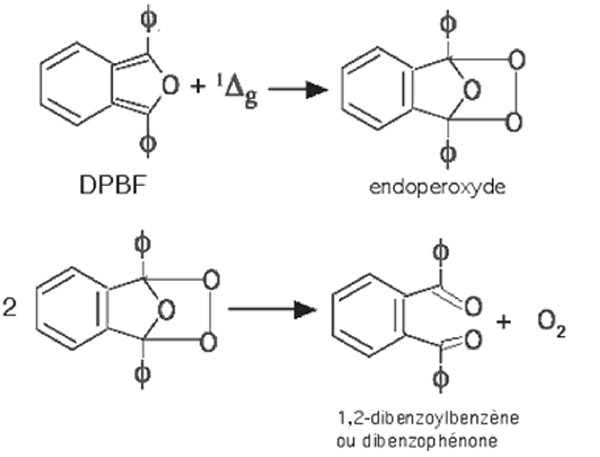
Fig. 34 : Réaction du DPBF avec l'oxygène singulet (d'après Howard,1975, réf 93).
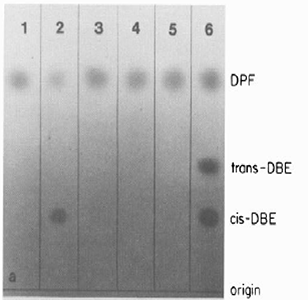
Fig. 35 : Séparation par du DPBF (DPF) d'avec les deux isomères de la dibenzophénone
(trans- et cis-DBE).
B.1.3.c. Le 1,4-diazabicyclo(2,2,2)octane ou DABCO107,108 (fig. 36)
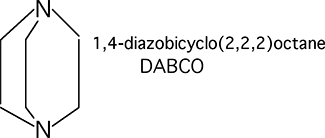
Fig. 36 : Formule du DABCO.
II s'agit d'un composé à effet piègeur douteux, spécifiquement parlant. En effet, s'il manifeste des propriétés de 1Δg-scavenger évidentes dans certaines réactions, il favorise au contraire l'attaque de certains composés par l'oxygène singulet : c'est le cas dans la réaction de 1Δg avec l'acide α-cétocarboxylique109, dont le DABCO augmente le rendement au lieu de le freiner. Le DABCO stimule également la chimioluminescence attribuée à la formation d'oxygène singulet dans certaines décompositions d'hydroperoxydes, alors que le DPBF l'inhibe84. II stimule aussi la chimioluminescence de 1Δg dimolaire produit au cours de la réaction de Mallet39,110 qui est, elle aussi, "quenchée" par le DPBF. Le DABCO, pourtant, est tonjours considéré comme un piègeur spécifique de 1Δg et plusieurs auteurs l'ont employé pour nier la présence de 1Δg dans les milieux biologiques : nous estimons que les arguments que nous venons d'exposer doivent inciter à plus de prudence au cours de l'utilisation de ce " 1Δg-scavenger".
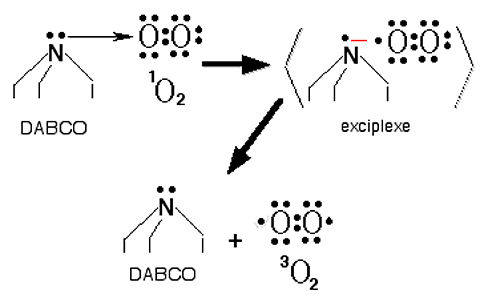
| Fig. 37 : Le "quenching" de l'énergie de 1Δg par le DABCO est un quenching physique par transfert de charge, respectant l'intégrité moléculaire du quencheur (A.5.1.b.) et ne peut s'exercer dans toutes les circonstances physico-chimiques. |
B.1.3.d. La tétraphenylcyciopentadienone111
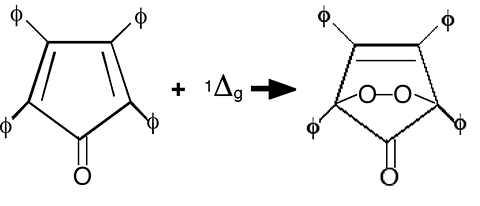
Fig. 38 : La réaction de la tétraphénylcyclopentadiènone avec 1Δg forme un endoperoxyde.
B.1.3.e. L'acide lipoique112
ce composé peut passer très facilement à l'état oxydé. Il réagit facilement avec 1Δg113.
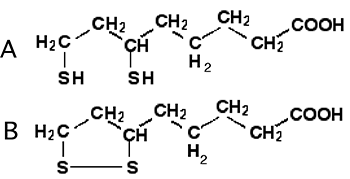
Fig. 39 : Acide lipoïque. A : forme réduite; B: forme oxydée.
B.1.3.f. Le diméthylfuranne114,115
Ce piègeur semble être aussi spécifique que le DPBF; 1Δg l'oxyde en 2-hydroxy-5-hydroperoxy-2,5-diméthylfuranne (fig. 40). Cependant, des doutes ont été émis quant à sa spécificité116.
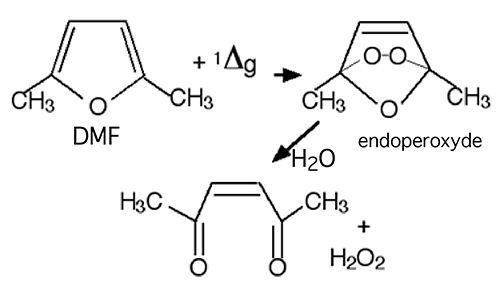
Fig. 40 : Réaction du diméthylfuranne avec 1Δg.
B.1.3.g. L'azide de sodium117
B.2. Possibilités de génération in vivo
Ce sont Allen et al.71 qui ont postulé, en 1972, la formation de 1Δg au cours de la phagocytose (voir B.2.2.3).
B.2.1. Génération non enzymatique
B.2.1.1. La dismutation de l'anion superoxyde
De l'oxygène singulet se forme-t-il au cours de la dismutation de l'anion superoxyde ? Voilà un sujet qui n'arrête pas de fournir matière à controverses. Arneson118 a proposé le schéma réactionnel suivant :
2O2- + 2 H+ → H2O2 + 1Δg (XIV)
Cette hypothèse a été accueillie très favorablement et plusieurs équipes ont postulé son exactitude pour aller plus avant11,18,23,67,119,120,121. Elle fut cependant niée par Poupko122.
Arneson118 avait proposé un deuxième schéma réactionnel, dérivant du premier :
O2- + •OH → OH- + 1Δg (XV)
Les considérations d'Arneson étaient étayées par des expériences au cours desquelles des effets, attribués à 1Δg, étaient atténués par la superoxyde-dismutase.
Thermodynamiquement, le premier mécanisme fut considéré d'abord comme possible, l'énergie dégagée couvrant facilement les 22 kCal séparant l'oxygène triplet de 1Δg, mais 3 ans après, Koppenol123 le contestait.
Le 2ième mécanisme est encore plus exothermique et permettrait d'atteindre un niveau d'énergie suffisant pour former 1Δg120,124,125.
La production de 1Δg pourrait survenir en présence d'un accepteur d'électron Acc :
O2- + Acc → 1Δg + Acc- (XVI)
Il y aurait transfert d'e-.
Se basant sur ces considérations, des auteurs96,126 ont affirmé que la toxicité de l'anion superoxyde s'expliquait par sa transformation en 1Δg et ont essayé de supprimer cette soi-disante production de 1Δg par utilisation de superoxyde-dismutase, proposant cette enzyme comme piègeur de l'oxygène singulet. Outre la SOD, Kellog et Fridovich114 ont suggéré que la catalase inhiberait la production de 1Δg ; ces travaux étaient basés sur l'étude des lipoperoxydations induites par le système hypoxanthine/xanthine-oxydase, inhibé par la SOD et la catalase; mais en aucune façon ces auteurs n'ont pu établir une génération d'oxygène singulet durant cette réaction enzymatique. King et al.127 ont démontré que, bien au contraire, le système hypoxanthine/xanthine-oxydase ne produit pas d'1Δg.
Les preuves expérimentales de cette genèse d'1Δg ont été fournies, soit par l'utilisation d'agents piègeurs présumés spécifiques de 1Δg (tels que le DPBF), soit par la détection d'une chimioluminescence que l'on a associée automatiquement à une formation de 1Δg.
Le DPBF peut donner des résultats douteux (voir B.1.3.b.). La chimioluminescence n'est pas forcémentune preuve d'apparition de 1Δg (voir B.1.3.b.), sauf si elle comprend la longueur d'onde λ = 1270nm. La formation d'1Δg à partir d'une dismutation d'O2- a cependant été promptement mise en doute122,128.
Relançant la controverse, Khan129 a précisé les conditions au cours desquelles, affirme-t-il, 1Δg peut être produit à partir de la dismutation de O2-; une des causes principales faisant obstacle à cette génération réside dans le quenching de 1Δg par O2- à hautes concentrations.
L'équation suivante a été proposée,
O2- + 1Δg → O2- + 3O2 (XVII)
permettant de supposer que la concentration en anion superoxyde, dans les systèmes biologiques, était trop faible pour que cet effet piègeur d'oxygène singulet soit efficace130. Pour ces auteurs, la genèse de 1Δg par dismutation de O2- est donc possible dans les milieux vivants.
B.2.1.2. Les réactions de décomposition non enzymatiques de H2O2
Comme dans la réaction de Mallet, un processus de transfert concerté de 2 électrons pourrait se produire au cours des réactions :
H2O2 + OH- → HOO- + H2O (XVIIIa)
H2O2 + HOO- → H2O + O2 (1Δg + 3O2) (XVIIIb)
_________________________________
2H2O2 → H2O + O2 (1Δg + 3O2) (XVIII)
Cette "disproportionated reaction" est catalysée par le cholestérol dispersé dans le stéarate de Na en système aqueux. Les 2 espèces oxygénées seraient obtenues dans le rapport 1Δg/3O2 = 1/3. Ce phénomène ne se produirait pas au cours de l'attaque de H2O2 par la catalase ou par la peroxydase du raifort131. Ces résultats mettent en doute des travaux antérieurs132.
B.2.1.3. La décomposition des hydroperoxydes
Des 1957, Russell133 supposa que 2 radicaux peroxydes secondaires peuvent former des ponts tétroxydes par réaction "headhead". C'est le cas de deux chaînes d'acides gras insaturés fixés parallèlement dans une même molécule de phospholipide ou de glycéride134.
Selon l'Hypothese de Howard et Ingold132, l'O2 formé serait 1Δg. Une première confirmation fut apportée par résonance paramagnétique électronique135. Les calculs de Ingold136 confirment que le mécanisme le plus probable, à température ordinaire, est celui de Russell133.
La confirmation expérimentale des réactions "head-head" a été apportée par marquage isotopique137. Cependant, d'autres mécanismes ont été proposés par Lindsay138. La réaction "cage" des radicaux alkoxy aboutit à une dimérisation puis une scission β-, parce que la diffusion à partir des cages est induite par la soustraction d'un H. Par une autre voie, la formation d'oxygène singulet, au cours de la réaction de Russell, allait être démontrée, prouvant en même temps la validité biologique de ce schéma.
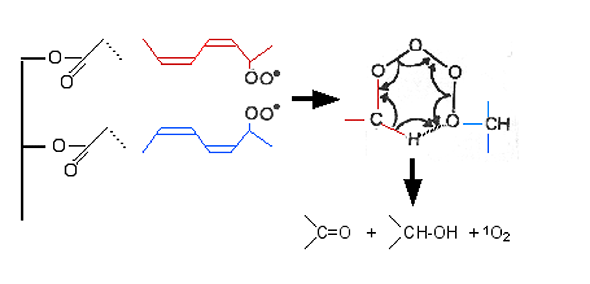
Fig. 41 : Réaction "head-head de Russell. A gauche : 2 chaînes grasses polyinsaturées parallèles porteuses d'un peroxyl -OO• (voir Initiation au Métabolisme de l'Oxygène, chap. X). Cette configuration peut se produire sur un triglycéride ou un phosphatide. Un pont tétroxyde peut se former, très instable, qui se rompt en 3 composés : une cétone, un alcool et une molécule d'oxygène à l'état singulet. |
Howes et Steele139 ont attribué à 1Δg la chimioluminescence émise durant la peroxydation lipidique "NADPH-mediated" par les microsomes hépatiques. Nakano et al.134 ont confirmé cette hypothèse en montrant que la superoxyde dismutase ne quenche pas la chimioluminescence. Ces auteurs affirmèrent avoir mis spectroscopiquement en évidence une formation de 1Δg au cours de "self-reactions" entre radicaux peroxy, in vitro, en présence d'ions cériques. En réalité, ils ont observé l'émission de nombreuses raies à 5200, 5780, 5900, 6350 et 7035 ångströms. Seules les deux dernières raies pouvaient témoigner d'une presence de 1Δg. Ces deux raies, par la suite, ne seront plus considérées comme preuves décisives de l'oxygène singulet. Les auteurs estiment que c'est au cours de réactions "head-head", par condensation de radicaux peroxy, que se produit l'oxygène singulet, par self-reaction (voir le schéma de Russell, fig. 41). Nakano et al. oublient malheureusement de citer, comme devanciers, les travaux de Russell.
Dans les systèmes biologiques, riches en acides gras non saturés, la production de l'oxygène singulet serait assurée par des "self-reactions" de sec-peroxy radicals, catalysées par le NADPH, au niveau des microsomes; cette hypothèse est confirmée par des travaux biologiques récents, tels la mise en évidence d'une chimioluminescence "NADPH-mediated "durant la phagocytose140.
Allen et al.71 ont mesuré la décomposition rapide d'hydroperoxydes d'acide linoléique en présence d'hèmes et d'hémoprotéines en une série de composés divers, dus a l'action d'espèces oxygénées radicalaires. Hawco et al.84 ont montré que la "self- decomposition" du linoléate, obtenue par Nakano134 en présence de chlorure de cérium, peut se produire en présence d'hématine ou de methémoglobine, à pH 7,5. Un dégagement d'oxygène est enregistré durant la première minute, en même temps qu'une chimioluminescence. Le rendement est plus élevé qu'avec le chlorure de cérium. Par une utilisation rationnelle des piègeurs d'oxygène singulet (voir B.1.3.), ces auteurs ont rendu très plausible l'hypothèse d'un dégagement de 1Δg au cours de cette réaction.
D'autres arguments ont été récemment fournis pour étayer l'hypothèse d'une génération de 1Δg à partir de lipoperoxydations:
a. Production de 1Δg par les systèmes enzymatiques "lipoxydase-like": Chan111 observe une co-oxygénation du DPBF au cours de l'incubation de linoléate avec la lipoxygénase; utilisant D2O comme catalyseur, il conclut que le blanchîment du cytochrome c par les lipoxygénases est dû à 1Δg.
b. Ces travaux seront cependant sérieusement infirmés par King et al.127 qui ont affirmé qu'une formation de 1Δg accompagne la peroxydation "NADPH-mediated" de lipides par les microsomes hépatiques, en presence de Fe3+: cette assertion repose sur la mise en évidence d'une co-oxygénation du DPBF durant la peroxydation.
c. Production de 1Δg au cours de la biosynthèse des prostaglandines: des démonstrations en ont été fournies par la co-oxygénation du DPBF, in vitro, durant l'activité des PGsynthétases141,142,143. Ce serait un système peroxydasique distinct qui produirait 1Δg, en même temps que fonctionnerait la PG-synthétase144.
B.2.1.4. Génération photochimique in vivo
Nous avons discuté plus haut des généralités de la production photochimique de 1Δg (A.3.1).
Ses applications en médecine font l'objet du chapitre C.
Foote et Ching145 ont souligné la forte réactivité de la bilirubine qui serait, pour eux, la substance la plus réactionnelle de l'environnement lipidique.
Dalton et Mc Auliffe146 ont fait remarquer que la présence de protoporphyrine IX à l'état libre a été constatée, à la surface des tissus, dans les cas de porphyries humaines.
B.2.1.5. Action de l'ozone:
Elle est proposée par divers auteurs31,147-150.
Kanowski et Sima150, notamment, ont mis en évidence la formation d'oxygène singulet par réaction de l'ozone avec l'acide ascorbique, phénomène favorisé par la présence d'ascorbate oxydase, ce qui affaiblit la thèse d'une protection contre l'ozone par l'ascorbate, car il se produit une forme activée de l'oxygène au moins aussi toxique que l'ozone. Les mêmes auteurs ont démontré la libération de 1Δg par réaction de O3 avec diverses molécules organiques, dont l'acide urique et le glutathion réduit.
B.2.2. Génération enzymatique
B.2.2.1. Activité de la lactoperoxydase151,152
L'émission d'une luminescence d'intensité maximale à 1270 nm a été démontrée dans le système lactoperoxydase/H2O2/Br-152.
La réaction suivante a été proposée
2H2O2 → H2O + 1Δg (XIX)
L'effet de Br- s'expliquerait comme suit:
H2O2 + Br- → OBr- + H2O (lactoperoxydase) (XX)
OBr- + H2O2 → H2O + Br- + 1Δg (XXI)
B.2.2.2. Activité de la chloroperoxydase
En 1966, Morris et Hager153 isolèrent une peroxydase végétale contenant une ferriprotoporphyrine IX par molécule et qui, tout comme la myéloperoxydase, peut réduire H2O2, mais aussi utiliser Cl- ou Br- comme donneurs d'électrons, ce qui permet des halogénations enzymatiques. Utilisant son détecteur ultrasensible, Khan put montrer que durant l'activité de la chloroperoxydase, un pic lumineux était émis aux environs de 1300 nm154. La même année, utilisant également un spectromètre sensible, Kanofsky et al. observèrent cette luminescence à 1268 nm155.
Les deux groupes l'attribuèrent à la génération de 1Δg, provenant de la réaction du substrat de la chloroperoxydase, H2O2, avec le produit formé, HOCl ou HOBr.
B.2.2.3. Activité de la myéloperoxydase (MPO) et phagocytose37,156-162
On a longtemps pensé que c'est durant les cascades de réactions se produisant au cours de la phagocytose par les polynucléaires que l'on peut espérer avoir un maximum de chance d'observer la formation d'oxygène singulet in vivo. En 1972, Allen et al. émirent l'hypothèse d'une production de formes excitées de l'oxygène au cours de la phagocytose et, parmi celles-ci, d'oxygène singulet71. En 1973, Allen et Steele faisaient dépendre la production de 1Δg de la MPO163.
Krinsky supposa, en 1974, que le puissant effet bactéricide des polynucléaires activés était dû à la formation d'oxygène singulet156. Mais dès 1976, Cheson et al. ont montré que l'émission lumineuse émise dans le visible au cours de la décroissance de 1Δg ne se retrouvait pas dans le spectre compliqué de la luminescence émise au cours de la phagocytose72.
En effet, ces éléments sont le siège d'une flambée respiratoire intense, produisant H2O2, lequel est le substrat de la myéloperoxydase existant dans ces cellules. De l'hypochlorite ClO- est formé. Si des molécules de H2O2 rencontrent ClO- néoformé, il se produira une réaction de Mallet avec dégagement de 1Δg.
Ces réactions devraient avoir lieu dans le phagosome ou à l'extérieur des cellules productrices. Il ne semble donc pas qu'il y ait des obstacles structuraux à la rencontre des deux molécules génératrices d'oxygène singulet.
Une démonstration indirecte, peu spécifique, d'une production de 1Δg durant la phagocytose fut fournie en 1977 par Rosen et Klebanoff157 qui montrèrent :
a) la conversion du DPBF en cis-DBE, en présence de myéloperoxydase;
b) la stimulation de cette conversion par D2O;
c) l'inhibition de cette conversion par le β-carotène, la bilirubine, le DABCO et l'histidine.
Démonstrations in vitro en systèmes purifiés
Une démonstration spécifique in vitro de la production de 1Δg durant l'activité in vitro de la myéloperoxydase (MPO + H2O2 + Br-) , fut faite par Khan37, grâce à l'appareillage spectroscopique décrit ci-dessus (B.1.1.b): la présence d'une raie à 1268 nanomètres était clairement mise en évidence.
Plus récemment,la même démonstration, utilisant une double diode au germanium, fut effectuée par Kiriyu et al.161, sur le système MPO + H2O2 + Cl-, plus proche de celui opérant dans le phagosome des polynucléaires. Un pic de luminescence à1270 nm fut enregistré, avec une distribution spectrale similaire à celle provenant de la décroissance de 1Δg.
Démonstrations in vivo
Mais les expériences visant à démontrer la formation de 1Δg dans le phagosome par l'existence de son pic lumineux à 1268 nm ont échoué dans le cas des polynucléaires neutrophiles164-167. Par contre, cette tentative a réussi dans le cas des polynucléaires éosinophiles168,169. On peut aussi retenir les expériences sur PMNs en présence de 9,10-diphénylanthracène (DPA: voir ci-dessus) réalisées par Steinbeck et al.170: le DPA était étalé sur des lamelles de verre ou couvrait des billes phagocytables. En extrayant au CHCl3, le DPA et son endoperoxyde, considéré comme spécifique de l'attaque du DPA par l'oxygène singulet, cette équipe a augmenté les raisons de croire en la production de 1Δg dans les phagosomes et dans le milieu extra-cellulaire. Sur la base de ces résultats, cette équipe a calculé que 19 % de l'oxygène consommé devenaient du 1Δg.
Des travaux plus récents ont attribué la chimioluminescence rouge émise par les neutrophiles activés à la tyrosine et à la bityrosine à des stades excités, mais non à la décroissance de 1Δg (λ = 500, 530 & 570 nm)171. Toutefois, comme le conseillaient Hampton et al.164 dans une revue sur les espèces oxygénées formées au cours de la phagocytose, ces travaux requièrent de nouvelles recherches.
Beaucoup moins convaincants sont les travaux réalisés par Razumovitch et al.162 qui ont utilisé la très peu spécifique chimioluminescence du luminol qui augmentait lors du traitement in vitro de la MPO par la néoptérine; ces auteurs en concluaient qu'il s'agissait d'une formation de 1Δg, puisque le DABCO inhibait totalement cette luminescence (voir le caractère douteux de l'inhibition par le DABCO en B.1.3.c.).
B.2.2.4. Activité de la catalase
De l'oxygène singulet se formerait au cours de l'activité de la catalase, dans certaines conditions172,173,174; cependant, Porter et Ingraham ont contesté la justesse de ces observations175. Jusqu'à plus amples investigations, la réaction:
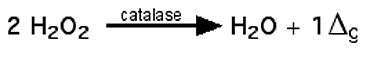 (XXII)
(XXII)
doit être considérée comme purement théorique, car elle n'est prouvée par aucune démonstration directe d'existence de 1Δg.
B.2.2.5 Génération par les oxygénases et les oxydases
Citons les travaux de Rosen et Klebanoff176 qui avaient affirmé que la NADPH oxydase génère 1Δg. Ces travaux n'ont pas été confirmés par spectrométrie.
Par contre, des publications récentes font état d'une production d'oxygène singulet par des cytochromes P450177,178,179. Malheureusement, aucune démonstration directe par spectrométrie spécifique n'a été fournie par ces chercheurs.
Marnett et al. observèrent l'émission d'une luminescence rouge durant l'activité de la cyclooxygénase in vitro141. Cadenas et al. reprirent ces expériences en 1983, en analysant la luminescence rouge au moyen de filtres qui leur permirent d'affirmer que les rayonnements présentaient deux pics à 634 and 703 nm180. Mais Kanofsky montra que cette luminescence rouge était un piège pour les chercheurs, car elle ne s'accompagnait pas de la radiation caractéristique à 1268 nm181 ; d'autres phénomènes que la décroissance de l'oxygène singulet peuvent produire une telle chimioluminescence.
Les lipoxygénases de soja émettent également, in vitro, durant l'attaque de l'acide linoléique, une luminescence caractéristique à 1268 nm182.
B.2.3. Conclusions (voir Kanofsky, réf. 166)
L'oxygène singulet est une forme de l'oxygène très réactionnelle, de très courte vie, qui oxyde très aisément une grande variété de molécules biologiques. La production biochimique de 1Δg a été proposée comme agent contribuant aux effets destructeurs observés dans nombre de processus biologiques. Divers modèles de systèmes biochimiques ont été considérés comme producteurs de cette forme d'oxygène.
On propose notamment l'oxydation des halides ionisés (Cl-, Br-, I-) catalysée par des peroxydases (exemple : la myéloperoxydase), l'oxydation de l'acide indole-3-acétique catalysée par une peroxydase végétale, l'oxydation des acides gras polyinsaturés à longue chaîne par les lipoxygénases et la décomposition d'hydroperoxydes en présence de bléomycine.
Mais une considération très importante doit être faite : les résultats obtenus à partir d'expériences menées in vitro ne peuvent être extrapolés sans de sérieuses analyses critiques aux systèmes biologiques.